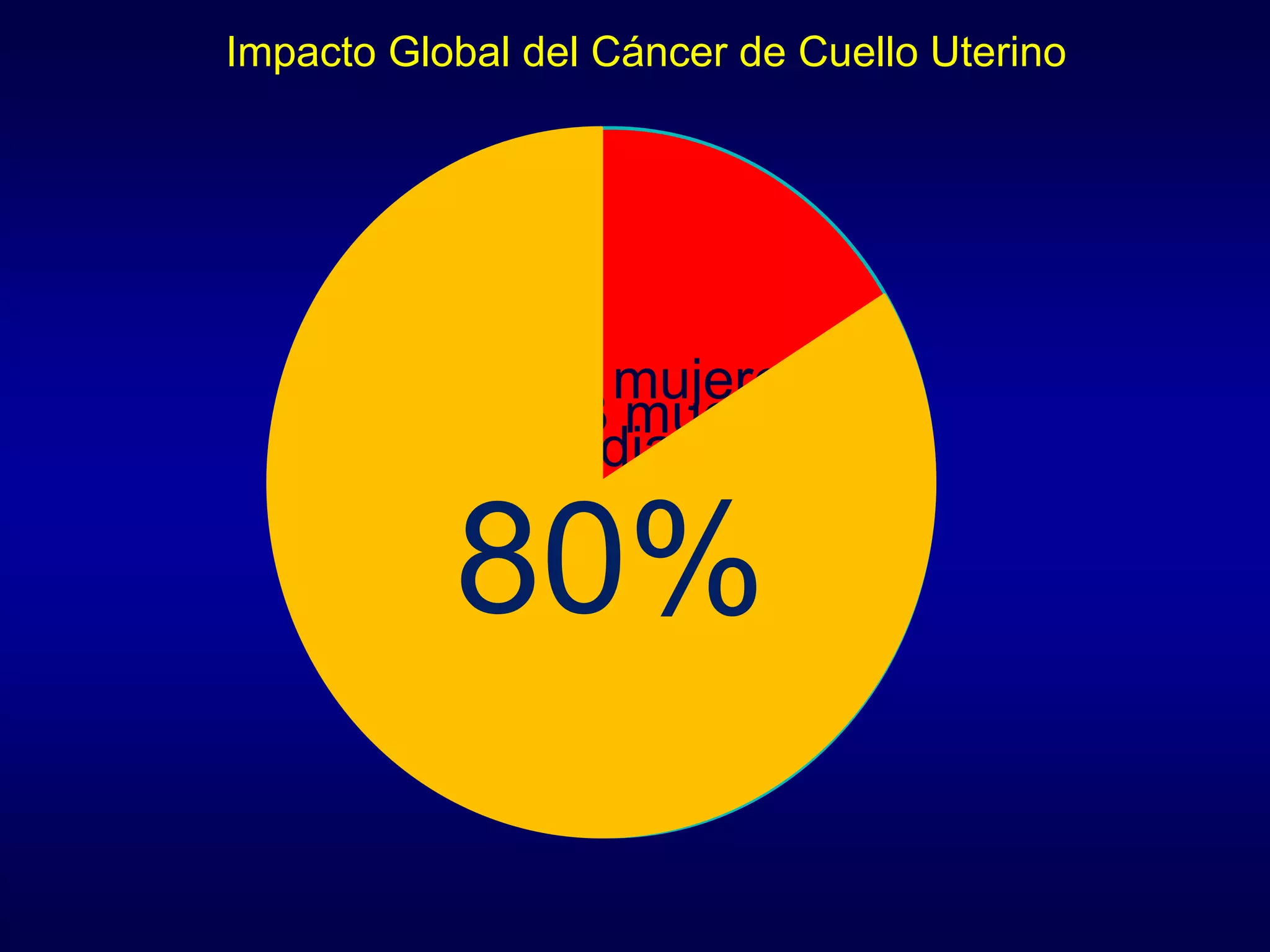
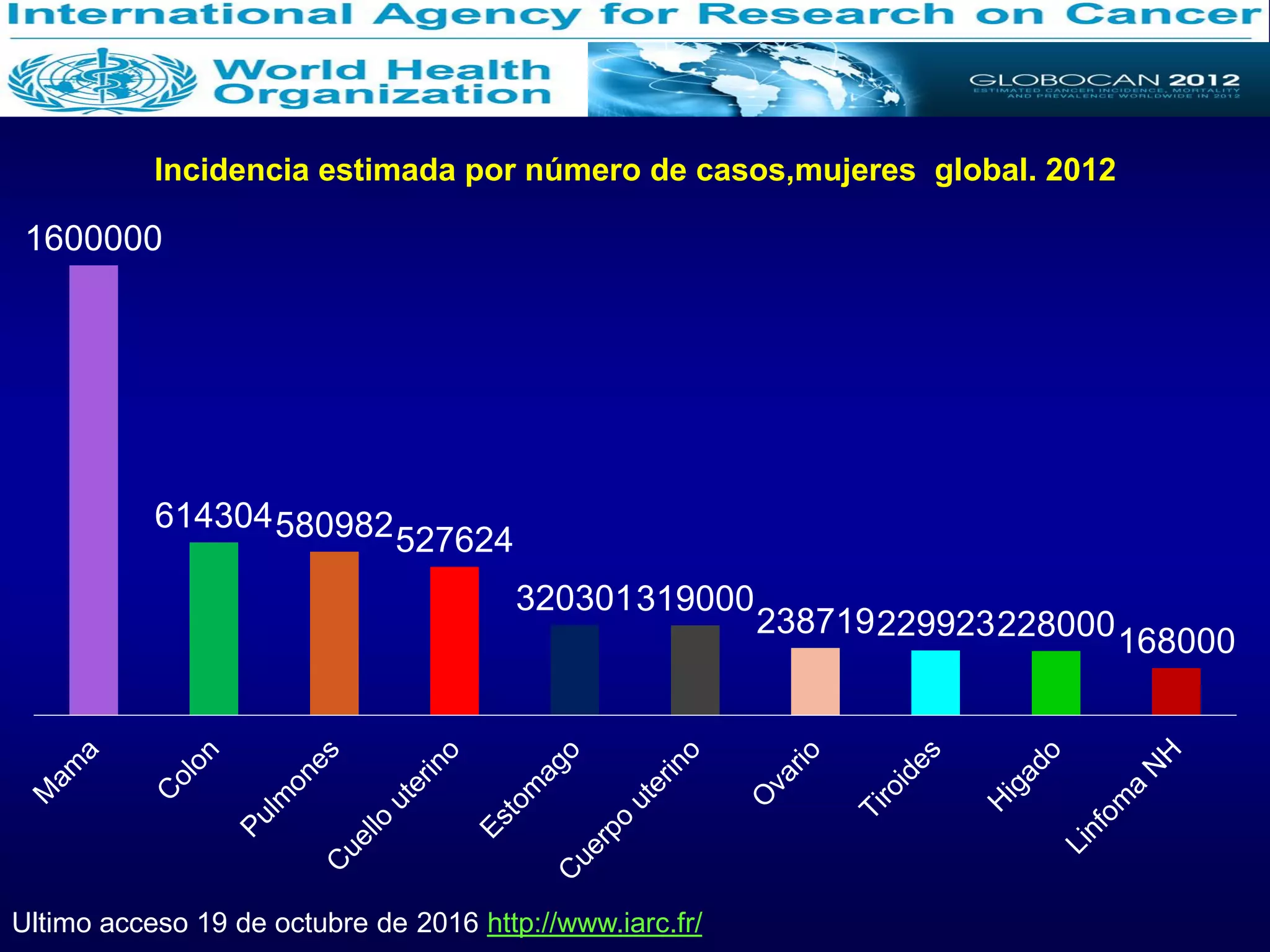
El documento describe el impacto epidemiológico del cáncer de cuello uterino en Bolivia y América Latina. 529,409 mujeres reciben un diagnóstico de cáncer de cuello uterino cada año en el mundo y 274,883 mueren por esta enfermedad. En América Latina se producen alrededor de 92,136 casos y 37,640 defunciones anualmente, lo que representa una pérdida económica estimada en más de US$3,600 millones. El cáncer de cuello uterino es la principal causa de mu
























![TIPOS MÁS FRECUENTES DE PVH DE ALTO RIESGO
ESTUDIOS EN BOLIVIA
TIPOS AUTOR PRINCIPAL
16 Y 31 Bosch X y colaboradores
31 Y 58 Lema C y colaboradores (Amazonia)
16 y 18 Rodriguez P y colaboradores ( Cochabamba)
16 y 18 Soria M y colaboradores (La Paz)
16 y 31 Teran Carolina (ciudad de Sucre y Santa Cruz)
51 y 16 Teran Carolina (ciudad de La Paz)
16 y 68 Esquivias J y colaboradores (ciudad de Santa Cruz)
[1] Bosch X y colaboradores Prevalencia mundial de la infeccuión por PVH. JNatl Cancer Inst 87;1995
[2] Lema C et al Human papiloma virus infection among Bolivian amazonian J Cancer Prev en http ://www.apocp.org
[3] Rodriguez P y colaboradores Prevalencia y caracterización genotípica del virus del papiloma humano en mujeres en áreas rurales y urbanas de Cochabamba. En: http ://www. Colloque.ird.fr
[4] Comunicación personal
[5] Teran C: Evidencia científica para el diseño de una política de introducción de las vacunas contra el VPH en la población femenina de Bolivia. Universidad Andina Simon Bolivar 2014
[6] Comunicación personal.](https://image.slidesharecdn.com/008personalejecutivosaludresumenccudr-170416171024/75/Contexto-clinico-y-epidemiologico-del-Cancer-de-Cuello-Uterino-Conferencia-para-autoridades-de-salud-resumen-Dr-Igor-Pardo-Zapata-27-2048.jpg)











