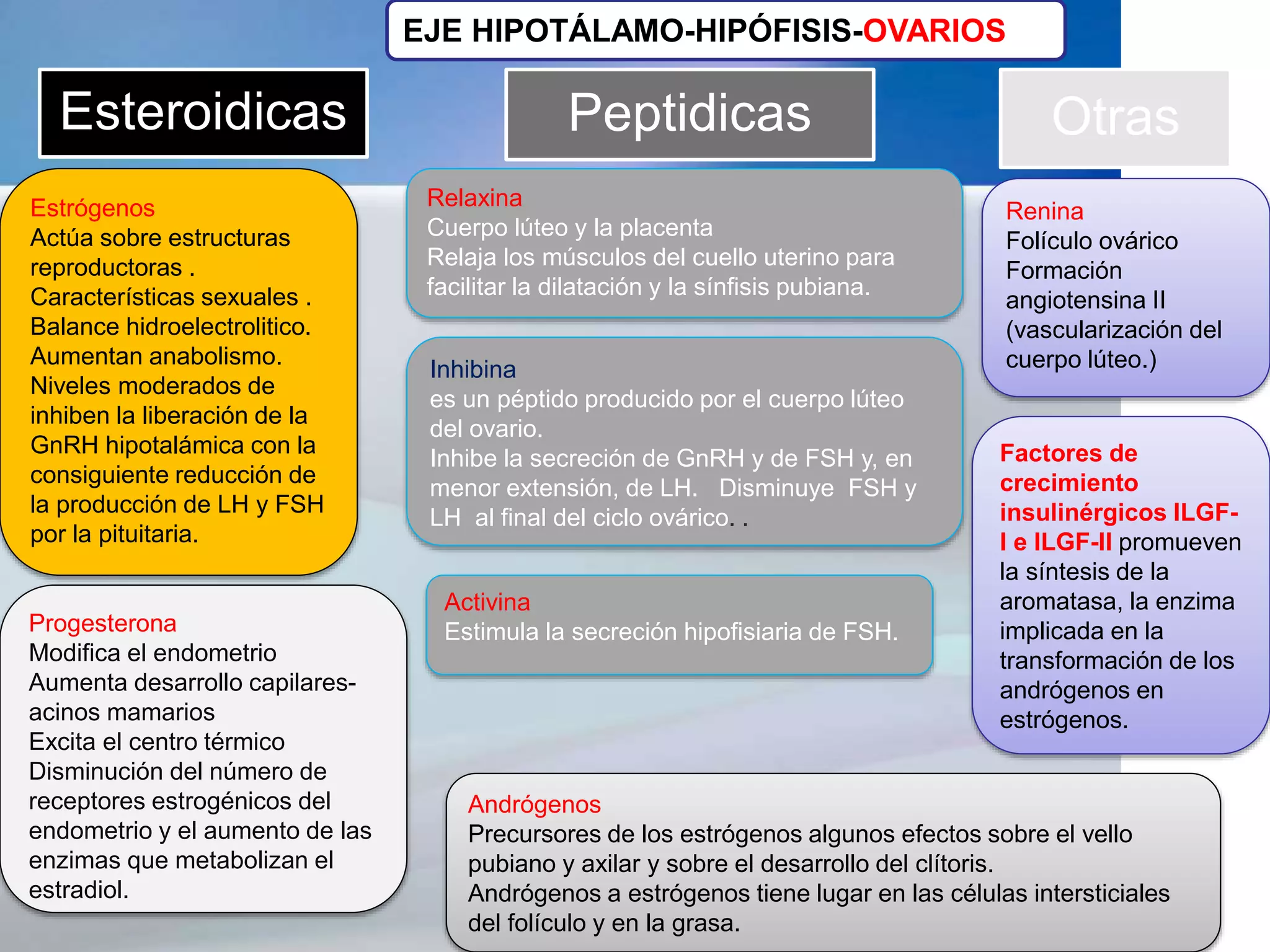
El documento proporciona información sobre el síndrome de ovarios poliquísticos (SOP), incluyendo antecedentes históricos, definiciones, prevalencia, impacto en la fertilidad y salud, y el eje hipotálamo-hipófisis-ovario. Se describe el SOP como un trastorno endocrinológico caracterizado por oligoovulación o anovulación crónica y aumento de las hormonas masculinas. Afecta a entre el 2-20% de las mujeres en edad reproductiva y puede causar problemas de fertilidad